Authentication
364x Tipe PPTX Ukuran file 1.11 MB
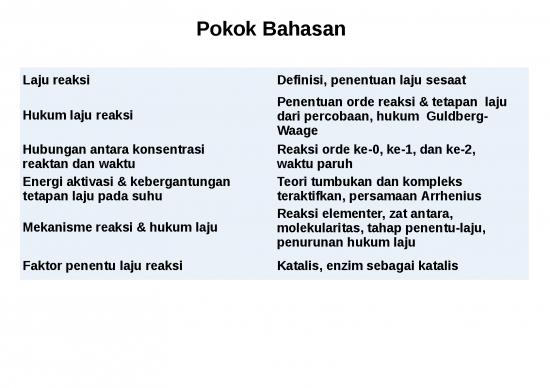
1. LAJU REAKSI
Termodinamika – apakah suatu reaksi dapat terjadi?
Kinetika – Seberapa cepat suatu reaksi berlangsung?
Laju reaksi (v) adalah penurunan konsentrasi reaktan atau
pertambahan konsentrasi produk terhadap waktu (M/s).
atau
A B
∆[A] = perubahan konsentrasi A dalam selang waktu ∆t
∆[B] = perubahan konsentrasi B dalam selang waktu ∆t
Karena [A] menurun terhadap waktu, ∆[A] bernilai negatif.
Faktor stoikiometri (koefisien reaksi) dalam laju reaksi:
aA + bB cC + dD
Contoh:
Reaksi pembentukan gas NO mengikuti persamaan berikut:
4 NH3(g) + 5 O2(g) 4 NO(g) + 6 H2O(g)
Apabila konsentrasi O menurun dengan laju 2.5 M/s. Maka laju
2
pembentukan NO ialah
Penentuan Laju Sesaat
Bagaimana jalannya suatu reaksi dapat kita ikuti?
* *
Perubahan suhu Pengendapan
* *
Perubahan warna Pelepasan gas
Contoh: Reaksi redoks larutan bromin dan asam format
– +
Br2(aq) + HCOOH(aq) 2 Br (aq) + 2 H (aq) + CO2(g)
Warna merah kecokelatan air bromin semakin pudar
hingga akhirnya hilang.
Penentuan Laju Sesaat
• Intensitas warna awal dan setelah waktu-waktu tertentu
diukur dengan alat spektrometer sinar tampak.
• Dari data serapan yang diperoleh, konsentrasi bromin
yang tersisa selama reaksi dapat ditentukan.
Laju sesaat = laju pada saat tertentu
Dengan mengalurkan [Br ] versus waktu (t), laju reaksi
2
sesaat pada t tertentu dapat dihitung sebagai kemiringan
garis singgung pada t tersebut.
kemiringan garis
singgung
kemiringan garis
singgung Kemiringan garis
singgung
no reviews yet
Please Login to review.